肺泡里的“修复工厂”! Sci Rep:类器官揭示上皮细胞与 “邻居” 成纤维细胞如何联手对抗肺损伤
来源:生物谷原创 2025-05-26 15:19
本研究开发肺泡类器官,发现其含肺泡上皮细胞、niche成纤维细胞等,损伤时触发巨噬细胞活化及促炎信号,诱导上皮细胞再生,表明该类器官可作肺组织修复及炎症反应模型。
在呼吸疾病发病率逐年攀升的当下,肺部损伤修复机制的研究成为医学领域的焦点。近日,韩国天主教大学首尔圣玛丽医院的研究团队在Sci Rep发表重要成果Enhanced application potential of alveolar organoids through epithelial and niche cell interactions,通过构建肺泡类器官(alveolar organoids, AOs),首次系统性揭示了肺泡上皮细胞、niche成纤维细胞与巨噬细胞在生理损伤下的复杂互作网络,为肺部疾病建模、药物筛选及再生医学提供了全新视角。

一、肺泡类器官:模拟天然肺组织的“微生态系统”
肺泡作为肺部气体交换的核心单元,其结构与功能依赖于上皮细胞(AT1/AT2)、成纤维细胞(如PDGFRα+间充质细胞)和免疫细胞(如肺泡巨噬细胞)的精密协作。传统二维培养难以模拟细胞间的空间互作,而本研究开发的三维肺泡类器官系统,通过从人肺组织分离原代细胞(含198例临床样本),在特定培养基(含FGF7、FGF10等生长因子)中诱导形成包含多种细胞类型的立体结构。
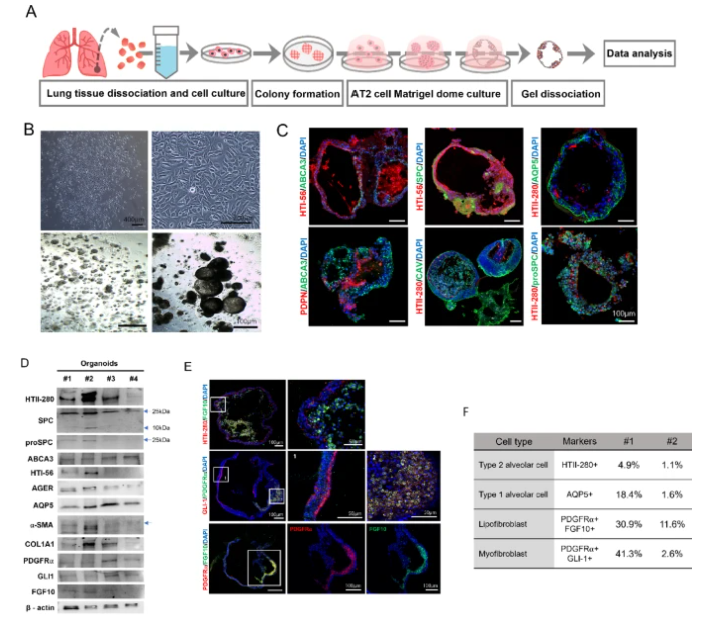
图 1. 肺泡类器官(AOs)的生成与表征
关键特征如下:
1. 细胞组成与功能验证:类器官中AT2细胞(表达HTII-280、pro-SPC)占比4.9%-1.1%,AT1细胞(AQP5+)占18.4%-1.6%,同时包含PDGFRα+脂肪成纤维细胞(30.9%-11.6%)和GLI1+肌成纤维细胞(41.3%-2.6%),与天然肺泡的细胞比例高度相似(图1)。免疫荧光证实,AT2细胞与PDGFRα+成纤维细胞紧密相邻,提示后者通过WNT信号维持AT2细胞干性。
2. 自我更新与分化能力:类器官在传代培养中可稳定维持3代以上,第3代仍表达AT1/AT2特异性标志物(如CAV、HTI-56),且成纤维细胞标志物(FGF10、GLI1)的表达水平与上皮细胞分化效率呈正相关,表明niche细胞对类器官的长期存活至关重要。
二、炎症损伤模型:类器官揭示肺修复的动态响应
研究团队利用博来霉素(BLM)和脂多糖(LPS)构建急性肺损伤模型,发现类器官可模拟天然肺组织的炎症-修复级联反应:
1. 巨噬细胞活化与炎症因子释放:损伤刺激后,CD206+(M2型)和CD169+肺泡巨噬细胞显著增殖,形态从静息态的圆形变为促炎态的伸长型,同时IL-6、TNFα、IL-1β等促炎因子表达上调,且caspase-1介导的IL-1β成熟过程激活,提示炎症小体通路参与修复(图4)。
2. 上皮细胞再生的细胞命运调控:炎症信号通过IFNα-STAT1/2通路驱动AT2细胞增殖,同时诱导其向AT1细胞分化。值得注意的是,非分选培养的类器官(保留完整niche细胞)在损伤后表现出更强的再生能力,AT2细胞增殖标志物Ki-67表达水平比单纯AT2细胞分选组高2.3倍,印证了niche细胞对上皮修复的支持作用。
3. 细胞互作的空间动力学:三维免疫荧光重构显示,FGF10+成纤维细胞在损伤区域聚集,与AT2细胞形成紧密接触;而GLI1+肌成纤维细胞则分布于类器官外围,可能参与基质重塑。这种空间分区模式与临床肺损伤样本中的细胞分布一致。
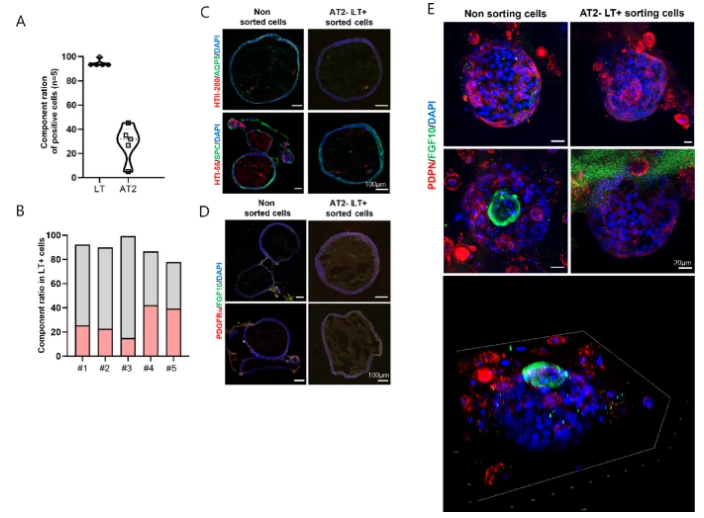
图 2. 分选与未分选细胞的类器官形成能力比较
三、从实验室到临床:类器官的转化医学价值
本研究构建的肺泡类器官系统具有三大核心优势:
1. 疾病建模的真实性:通过保留天然niche细胞,类器官可模拟不同个体的肺组织异质性。例如,供体间类器官形成效率差异(最高78.9%)与niche细胞标志物(FGF10、GLI1)表达水平直接相关,为个性化药物筛选提供了生理相关模型。
2. 免疫研究的可控性:在无血管微环境中,研究者首次直接观察到肺泡巨噬细胞与上皮细胞的双向调控——巨噬细胞通过分泌IL-1β促进AT2增殖,而上皮细胞来源的IFNα反馈调节巨噬细胞极化,这一机制为靶向炎症-修复平衡的药物开发提供了新靶点。
3. 再生医学的潜力:传代实验表明,类器官中的AT2细胞在niche支持下可维持至少3代的分化能力,提示其作为细胞治疗种子细胞的可行性。结合临床样本的供体特征(如年龄、基础疾病),未来有望建立预测肺修复能力的生物标志物模型。
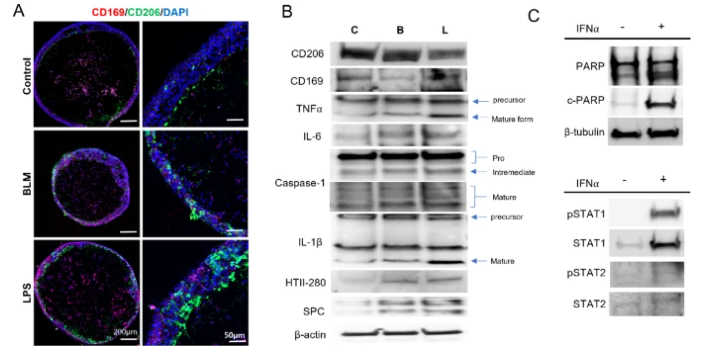
图 3. AOs内肺泡巨噬细胞的先天性炎症反应
小结
从慢阻肺到肺纤维化,从新冠后遗症到先天性肺发育异常,人类对肺部疾病的认知始终受制于模型系统的局限性。这项研究通过整合原代细胞培养、三维类器官构建与多组学分析,成功搭建了一个高度模拟天然肺泡微环境的研究平台。正如通讯作者在讨论中指出,肺泡类器官不仅是“培养皿中的肺组织”,更是连接基础研究与临床转化的桥梁——它既能揭示细胞互作的分子密码,也能为药物研发提供“人体试验前”的精准评估体系。随着血管化、神经支配等复杂微环境的逐步重构,类器官技术或将彻底改变肺部疾病的诊疗范式,让“再生肺泡”从实验室走向临床不再遥远。(生物谷Bioon.com)
参考文献:
Lim MJ, Kim SJ, Jo A, Kim SW. Enhanced application potential of alveolar organoids through epithelial and niche cell interactions. Sci Rep. 2025;15(1):17538. Published 2025 May 20. doi:10.1038/s41598-025-01853-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


